DIAGNOSTICO DE LABORATORIO DE LAS PARASITOSIS
El diagnóstico de las infecciones parasitarias puede establecerse de dos maneras fundamentales:
- por métodos directos, diseñados para observar o detectar el parásito o alguno de sus elementos identificables
- por métodos indirectos, dirigidos a hacer evidente la respuesta inmune del hospedero frente al parásito. Los métodos indirectos de diagnóstico tienen fundamental importancia para el diagnóstico de parasitosis en que es imposible o muy difícil la visualización directa del parásito o de alguno de sus elementos o para controlar la evolución post-terapéutica de la infección.
Dentro de los métodos directos se encuentra:
- el análisis parasitológico de heces, el cual consta de un examen microscópico directo, con y sin coloraciones
- examen macroscópico por tamizado
- métodos de concentración.
La concentración y la separación de los quistes de protozoos y huevos de helmintos de otros elementos de la muestra fecal pueden ser de gran ayuda para el diagnóstico. Se consiguen por sedimentación, flotación o una combinación de ambos.
La sedimentación se lleva a cabo suspendiendo la muestra fecal en agua o en una solución acuosa para que sedimente de forma natural o acelerando el proceso por centrifugación. La flotación consiste en suspender la muestra en un medio de densidad superior a la de los quistes y los huevos, que por su capacidad de flotación se concentran en la superficie.
El diagnóstico de las infecciones parasitarias intestinales puede establecerse por métodos directos o indirectos como señalamos anteriormente. La selección de una o más técnicas dependerá de qué especie parasitaria y en qué fase de su ciclo evolutivo es necesario diagnosticar, dadas las diferentes cualidades de cada método.
Examen parasitológico de heces
Las muestras de heces pueden ser recogidas de varias maneras:
- Heces frescas sin conservantes: Si el paciente presenta deposiciones líquidas o heces con moco y sangre, se debe examinar rápidamente una muestra de las mismas siempre que no haya tomado carbón, crema de bismuto, sustancias baritadas o esté medicado con hierro.
- Heces con conservantes: El paciente debe colocar en un frasco con conservante (formol 10%, SAF, etc.), una pequeña cantidad de materia fecal de todas las deposiciones del día y durante 8 días seguidos.
- Heces después de tomar un purgante salino: El paciente durante 2 días no debe ingerir verduras de hoja, legumbres o cítricos. Puede ingerir bananas o manzanas peladas, es decir, frutas que no tengan hollejo. La noche anterior a la recolección de la muestra deberá tomar un purgante salino (no oleoso) y luego recogerá la 2° deposición en un frasco limpio, preferentemente de tapa a roscas.
Los distintos modos de recolección presentan ventajas y desventajas. Las heces frescas permiten ver la movilidad de los protozoos y larvas de helmintos. Las que tienen conservantes permite obtener parásitos que se eliminan de manera intermitente, aunque Trichomonas hominis no se detecta con conservantes.
Las heces recogidas luego de la administración de un purgante salino, permiten el diagnóstico más rápido, pero no puede realizarse en personas con dolores intestinales, diarrea o en quienes estén contraindicados los purgantes. La muestra debe ser procesada rápidamente. Permite ver la movilidad de los protozoos y se logra una mejor visualización de los macroparásitos dado que en el tamizado aparecen pocos restos debido a la no-ingestión de verduras, legumbres y frutas.
La recolección seriada de las heces puede darse a todos los pacientes y al recoger durante 8 días aumenta la posibilidad de hallar los parásitos que tengan un ciclo más largo y que puedan completarlo durante la recolección. Esta recolección es engorrosa para el paciente; el formol inmoviliza a los protozoos pero conservan su morfología lo que hace posible su diagnóstico.
Una vez remitidas al laboratorio las muestras obtenidas como se ha señalado anteriormente se procede al análisis parasitológico.
Análisis Parasitológico
Las muestras de heces deben ser homogeneizadas. Si las heces son formadas se agrega agua o solución fisiológica hasta obtener una muestra semi-líquida.
Se realiza:
a) Examen microscópico directo, con objetivos de 100x y 400x aumentos para la búsqueda de trofozoitos, quistes, ooquistes, huevos y/o larvas de parásitos intestinales. Esta observación microscópica puede hacerse sin coloración o con coloraciones húmedas como lugol, eosina, azul de metileno, etc.
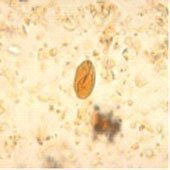
Quiste de Giardia intestinalis
Examen microscópico con lugol
b) Concentración de huevos, larvas y quistes en heces ha llegado a ser un procedimiento de rutina como parte de un examen completo para la detección de los parásitos intestinales, que se puede realizar como complemento del examen directo.
c) Examen macroscópico: consiste en tamizar la muestra una vez concluido el examen microscópico directo, para identificar la morfología de los helmintos macroscópicos.
d) Examen microscópico previa coloración: con las heces llegadas al laboratorio u obtenidas por métodos de concentración se pueden preparar extendidos para ser fijados y teñidos con coloraciones específicas para cada parásito que se quiera investigar.
e) Escobillado anal: el análisis parasitológico se debe completar, sobre todo en los niños, con un hisopado anal seriado: es una técnica específica para la detección de Enterobius vermicularis, nematode cuya hembra coloca los huevos en la zona perianal. Los exámenes microscópicos y macroscópicos de heces presentan poca sensibilidad para este parásito. La técnica consiste en pasar ocho gasas estériles por la zona perianal, por la mañana y sin higiene previa. Se realiza durante ocho días, recogiendo las gasas en un frasco con formol al 10%. Obtenida la muestra, se centrifuga durante 10 minutos a 3.000 rpm, se descarta el sobrenadante y el sedimento se observa por examen microscópico directo con 100x y 400x aumentos para la búsqueda de huevos del parásito. Debe agotarse el sedimento antes de dar por negativo el análisis.
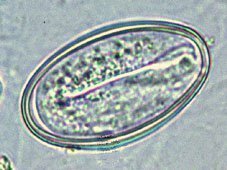
Huevo de Oxyuris vermicularis
Observación microscópica de muestral obtenidoa por escobillado anal
Montaje húmedo directo: este método sigue siendo el “gold standard” para el diagnóstico de la enfermedades parasitarias. Se usa principalmente para observar las características morfológicas de los protozoos y detectar la movilidad de los mismos en su forma de trofozoito. El preparado directo se realiza con una pequeña cantidad (una gota) de heces entre porta y cubreobjeto; no debe ser mayor porque resultaría demasiado espesa para el examen, ni menor porque disminuiría la posibilidad de encontrar parásitos. La observación se realiza utilizando un objetivo de 10x aumentos y ante un elemento sospechoso se examina con 40x aumentos.
Para poder observar con más detalle la morfología de los protozoos (especialmente los núcleos) se puede hacer un montaje húmedo coloreado, colocando una gota de colorante en el borde del portaobjeto o se prepara un nuevo montaje. Varias soluciones de yodo son recomendadas, por ejemplo Lugol y de Dobell y O´ Connor; otras como solución de eosina o azul de metileno.
Los trofozoitos y quistes de protozoos, huevos o larvas de helmintos y ooquistes de Isospora belli pueden ser identificados en el extendidos directo. Los ooquistes de Cryptosporidium difícilmente son observados, salvo en grandes infecciones, al igual que las esporas de Microsporidium que son muy pequeñas y de forma semejante a restos en materia fecal.
Extendidos coloreados permanentes: la detección y la correcta identificación de la mayoría de los protozoos intestinales dependen del examen de estos extendidos observados con un aumento de 100x. La utilización de extendidos permanentes no solamente nos proporciona un archivo durable de los protozoos, sino que pueden ser utilizados, cuando la identificación es dificultosa, para consultar con especialistas.
El método más clásico es la hematoxilina férrica de Heidenhain, pero la generalidad de los laboratorios seleccionan técnicas más breves como la coloración Tricrómica.
Es importante mencionar que la mayoría de las dificultades en las coloraciones de trofozoitos y quistes se deben a una fijación inadecuada, al uso de preparados muy densos o por heces muy viejas.
Técnicas de Concentración
La concentración de huevos, larvas y quistes en heces ha llegado a ser un procedimiento de rutina como parte de un examen completo para la detección de los parásitos intestinales y se puede realizar como complemento del examen directo.
Los procedimientos de concentración permiten la detección de protozoos y/o helmintos empleándose dos métodos: de sedimentación y flotación, o una combinación de ambos, para separar los protozoos y los huevos de helmintos de las heces, utilizando las diferencias en el peso específico.
Se deben emplear cuando la cantidad de muestra fuera pequeña, en un control de tratamiento o cuando se deba transportar poca cantidad de muestra a un lugar distante.
1- Concentración por Sedimentación
Los parásitos se concentran por acción de la gravedad, suspendiendo las heces en agua corriente, agua destilada o solución salina y dejando que sedimenten naturalmente o por centrifugación. Estos métodos son principalmente útiles para la concentración de quistes, ooquistes y huevos.
Ventajas: es fácil de realizar, no requiere observación microscópica inmediata y se puede aplicar a la concentración de la mayoría de los parásitos intestinales.
Desventajas: la observación microscópica puede dificultarse por concentración de elementos no parasitarios.
Sedimentación espontánea:
- Método de sedimentación sencilla
1- Homogeneizar unos 10 gramos de heces en 10 veces su volumen de agua corriente.
2- Verter la materia fecal en copas de vidrio o vasos de precipitado de 250 a 500 ml
3- Dejar que sedimente durante 1 hora.
4- Eliminar por sifón los dos tercios superiores, o verterlos con cuidado, para eliminar los detritus.
5- Agregar agua hasta llenar casi el recipiente y resuspender las heces con varilla.
6- Repetir la operación 1 o 2 veces más hasta que el sobrenadante quede relativamente límpido.
7- Eliminar el líquido y con una pipeta obtener una pequeña porción del sedimento para
8- Observación microscópica.
Es un método lento y de poca concentración para los protozoos intestinales. Los huevos de helmintos sedimentan en el fondo del recipiente en un estado viable y sin deformación.
- Método de Lumbreras modificado
Se utiliza para la búsqueda de huevos de Fasciola hepática en heces o bilis. No se puede utilizar un método de centrifugación porque los huevos se rompen ni de flotación porque son muy pesados.
1- Colocar 2 ml de la muestra (heces o bilis) en una copa de Lumbreras o tubo de centrífuga.
2- Agregar 5 ml de solución detergente al 10% para emulsionar las grasas.
3- Agregar 0,5 ml de alumbre férrico al 1% para favorecer el gradiente de densidad.
4- Homogeneizar suavemente.
5- Dejar en reposo 30 minutos.
6- Sacar con pipeta pasteur una gota del fondo de la copa.
7- Observar con microscopio.
Sedimentación por centrifugación:
- Método de Charles Barthelemy modificado por Bacigalupo y Rivero
1-Mezclar 10 gramos de heces con 50 ml de solución fisiológica, o agua de la canilla.
2-Tamizar a través de un colador metálico.
3-Filtrar sobre gasa en un embudo.
4-Recoger 10 ml del filtrado en un tubo de centrífuga.
5-Centrifugar 5 minutos a 1500 rpm. Descartar el sobrenadante.
6-Repetir esta operación 3 veces o hasta que el sobrenadante quede límpido.
7-Resuspender el sedimento con solución fisiológica o agua de la canilla más 2 ml de éter sulfúrico. Tapar con tapón de goma y agitar vigorosamente para extraer las grasas.
8-Centrifugar 1 minuto a 1500 rpm. Descartar el tapón graso de un golpe seco, conservando el sedimento.
9-Examinar con microscopio el sedimento.
- Método de formol- éter o de Ritchie
1- Filtrar 10 ml de suspensión de heces por un embudo con una capa de gasa.
2- Recoger 10 ml del filtrado sobre un tubo de centrífuga.
3- Centrifugar 5 minutos a 2000 -2500 rpm. Descartar el sobrenadante.
4- Repetir esta operación 3 veces o hasta que el sobrenadante quede límpido.
5- Resuspender el sedimento con formol 10%. Dejar 5 a 10 minutos en reposo.
6- Agregar 3 ml de éter sulfúrico. Tapar con tapón de goma y agitar vigorosamente 30 segundos para extraer las grasas.
7- Centrifugar 1 minuto a 1500 rpm. Se forman cuatro capas: 1) capa de éter, 2) tapón de restos fecales, 3) capa de formol, 4) sedimento. Descartar las 3 capas primeras, conservando el sedimento.
8- Examinar con microscopio el sedimento.
2- Técnicas de Flotación
El método de flotación emplea un medio líquido más pesado que los parásitos permitiendo que los mismos suban a la superficie y puedan ser recuperados de la película superficial.
Ventajas: el preparado es más límpido, facilitando la observación microscópica.
Desventajas: debe hacerse la observación microscópica en menor tiempo debido a que la película superficial puede destruirse y los parásitos caer al fondo del tubo, a su vez, los parásitos de mayor peso que la solución empleada no flotarán.
Existen varios métodos de flotación, el más utilizado es el método de Faust
- Método de Faust o de Sulfato de Zinc al 33%
La concentración de sulfato de zinc para hacer flotar los elementos parasitarios tiene un peso específico de 1.180. Solución acuosa de sulfato de zinc puro: 333 g. Agua destilada c.s.p.: 1.000 ml
1-Mezclar 10 gramos de heces con 50 ml de solución fisiológica o agua de la canilla.
2-Tamizar a través de un colador metálico.
3-Filtrar sobre gasa en un embudo.
4-Recoger 10 ml del filtrado sobre un tubo de centrífuga.
5-Centrifugar 5 minutos a 1500 rpm. Descartar el sobrenadante.
6-Repetir esta operación 3 veces o hasta que el sobrenadante quede límpido.
7-Agregar al sedimento final 2 o 3 ml de solución de sulfato de zinc al 33% y homogeneizar con varilla.
8-Completar con sulfato de zinc el tubo de centrífuga sin volver a homogeneizar.
9-Centrifugar 1 o 2 minutos a 1500 rpm.
Extraer con aro de alambre unas gotas de la película superficial sin retirar el tubo de la centrífuga o haciéndolo con sumo cuidado para evitar que por agitación se destruya la película.